
皮肤T细胞淋巴瘤IL-2受体靶向免疫疗法Lymphir在美获批
发布日期:2024-08-11 17:04 点击次数:138
皮肤T细胞淋巴瘤是一种非霍奇金淋巴瘤,主要影响皮肤。目前除了只有少数人符合条件接受的同种异体干细胞移植外,没有治愈性疗法。近日,美国FDA批准了一种IL-2受体靶向免疫疗法,为这种疾病患者提供了一种新型且无交叉耐药性的治疗选择。
据Citius制药昨日宣布,FDA已批准其新型免疫疗法Lymphir(denileukin diftitox-cxdl),用于治疗至少接受过一次全身治疗后的复发或难治性皮肤T细胞淋巴瘤(CTCL)。该公司预计将在未来五个月内推出该药物。
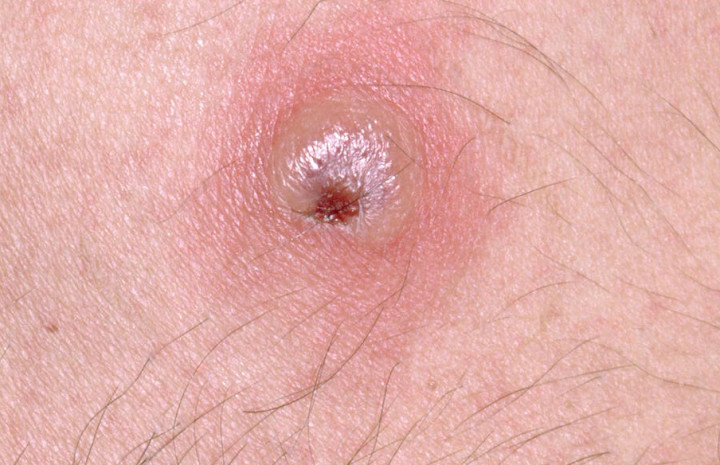
皮肤T细胞淋巴瘤是两种皮肤淋巴瘤中最常见的一种,因为它发生于T淋巴细胞而不是B淋巴细胞。其会在皮肤上引起红色、鳞状、发痒的斑块,经常被误诊为湿疹。男性发病率是女性的两倍,大多数在50岁后才被诊断出患有这种疾病。少数患者病情会发展为晚期,出现肿瘤形成、溃疡,并影响淋巴结、血液和内脏器官。大多数患者病情发展缓慢,可治疗,通常不会危及生命。
Lymphir是卫材的皮肤T细胞淋巴瘤治疗药物Ontak的改良版,Ontak于1999年至2014年在美国上市。但由于存在与细菌表达有关的制造问题,卫材于2014年将Ontak撤市。在研发出一种更纯净的Ontak配方来解决这些制造缺陷后,Citius制药接手了该药物的研发。
该药物是一种重组融合蛋白,旨在将白喉毒素(DT)的杀细胞作用导向表达IL-2受体的细胞。进入细胞后,DT片段被裂解,游离的DT片段会抑制蛋白质合成,导致细胞死亡。该药物显示出通过对表达IL-2R的肿瘤的直接杀细胞作用来消耗免疫抑制调节性T淋巴细胞和抗肿瘤活性的能力。
Citius制药在其新闻稿中指出,Lymphir是唯一一种针对恶性T细胞和调节性T细胞上的白细胞介素2(IL-2)受体的皮肤T细胞淋巴瘤疗法。此前,该药已于2021年在日本获得监管部门批准,用于治疗皮肤T细胞淋巴瘤和外周T细胞淋巴瘤。
批准基于一项针对69名复发或难治性I至IV期皮肤T细胞淋巴瘤患者的3期试验(研究302;NCT01871727)。试验中,患者在每个21天周期的第1天至第5天每天接受Lymphir 9mcg/kg静脉输注,并持续接受Lymphir治疗,直至病情进展或出现不可接受的毒性。疗效评估基于客观缓解率(ORR)。
结果显示,接受Lymphir治疗的患者的客观缓解率为36.2%。其中,完全缓解率为9%;不分缓解率为27%。52%的患者缓解持续时间至少6个月;20%的患者缓解持续时间至少12个月。对治疗有缓解的中位时间为1.4个月(范围:0.7至5.6个月)。在缓解患者中,中位持续缓解时间为6.5个月(范围:3.5+个月,23.5+个月)。
此外,研究人员还发现,84.4%的可评估皮肤患者的皮肤肿瘤负担有所减少,12.5%的皮肤病完全消失。研究人员还评估了瘙痒症作为探索性终点,其中31.7%的患者表现出临床显著改善。
试验中,至少20%的患者出现的常见副作用包括转氨酶升高、白蛋白降低、水肿、恶心、疲劳、皮疹、发冷、便秘、血红蛋白降低、肌肉骨骼疼痛、发烧和毛细血管漏综合征。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指导,请咨询主治医师。
